Weesgeneesmiddelen: een moeizame weg
Weesgeneesmiddelen: een moeizame weg
MADRID / EFE / ANA SOTERAS dinsdag 28/02/2017
Degenen die aan zeldzame ziekten die geen genezing look met de hoop om weesgeneesmiddelen hebben, heeft sommige geneesmiddelen die gericht zijn op een zeer kleine populatie en waarvan de investeringen in onderzoek en ontwikkeling niet compenseren de farmaceutische industrie als niet voor de prikkels die zij ontvangen. Op Wereld Zeldzame Ziekten Dag, gewijd aan onderzoek, gaan we door de zware reis van een wees
drug.Overig nieuws
- Patiënten met zeldzame ziekten een staatsfonds voor hun behandelingen
- Wat zijn biologics?

In Spanje, meer dan drie miljoen mensen lijden aan een aantal van de meer dan 7.500 zeldzame ziekten of ultrarraras (die minder dan 5 op de 10.000 mensen beïnvloeden), maar slechts 6% heeft een specifieke behandeling.
De Orphans drugs. Ze zijn gericht op de bestrijding van deze ziekten. Van de 95 door het Europees Geneesmiddelenbureau (EMA) sinds 2002 is goedgekeurd, zijn 53 tot nu toe in Spanje verkocht, volgens de Spaanse vereniging bijgewerkte Laboratory wezen en Ultrahuérfanos Drugs (AELMHU) gegevens.
Dit partnership geeft dat er sprake is van een dalende trend in de afgelopen jaren: in de periode 2002-2011 als de 42 weesgeneesmiddelen goedgekeurd in Europa, 38 gemachtigd waren Spanje (90,5%) in de periode 2012-2015, van 44 van de EMA goedgekeurde slechts 13 verkregen groene licht in Spanje (29,5%).
Met betrekking tot de tijd die verstreken is sinds de goedkeuring door de EMA tot marketing in Spanje besteden gemiddeld twintig maanden.
In die zin is de Spaanse Federatie voor zeldzame ziekten (EFRO) zorgt ervoor dat een medicijn kan oplopen tot twee jaar aan gezinnen en het feit dat elke regio is geconfigureerd als een standalone systeem doet niet allemaal hetzelfde toegang te hebben bereikt deze geneesmiddelen, zodat ze beweren enige criteria voor de toegang en het versnellen van het proces van commercialisering.
AELMHU, die samen meer dan een dozijn farmaceutische en biotechnologische bedrijven gewijd aan de ontwikkeling van innovatieve gerichte therapieën voor patiënten met een zeldzame en ultrarraras ziekten brengt, een verslag van 2015 zegt dat "slechts één van tussen de 5.000 tot 10.000 moleculen eindelijk onderzocht op de markt komt "en ze besteden tussen 10 en 12 jaar geleden dat de synthese van een geneesmiddel aan marketing.
De gemiddelde investering voor een nieuwe behandeling is 1.100 miljoen euro.

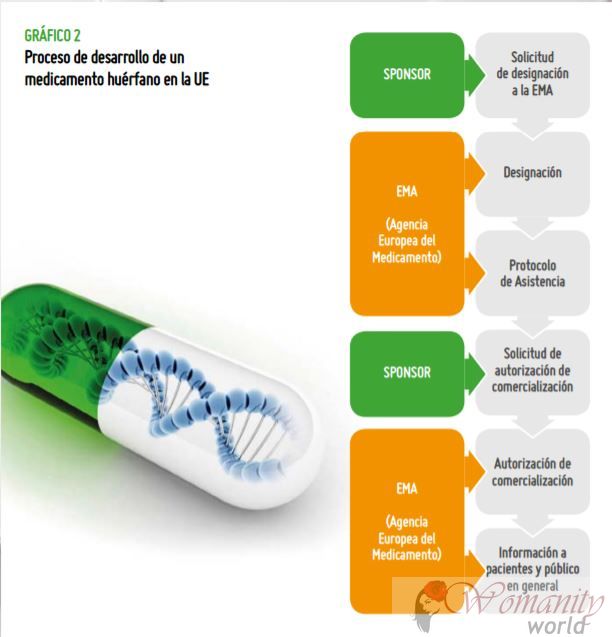
De stappen van weeskinderen
drugs.In het proces van ontwikkeling van een weesgeneesmiddel er twee hoofdfasen:
1. De aanduiding wordt uitgevoerd door zowel de EMA in Europa, en de Food and Drug Administration (FDA) in de Verenigde Staten. Aanwijzing geeft aan dat er bewijs is dat deze drug effectief is als preklinische testen kan zijn. In de EMA, in dit geval, dan activeren ze hulp of stimulansen om de klinische ontwikkeling (testen op patiënten)
voort te zetten.- Tien jaar van exclusiviteit in de EU na de handel brengen.
- gratis wetenschappelijk advies: EMA-ondersteuning op diverse tests en proeven worden uitgevoerd om de kwaliteit, veiligheid en werkzaamheid van het geneesmiddel aan te tonen.
- Vermindering of opheffing van de vergoedingen in de procedure.
- Het bevorderen van onderzoek: door middel van financiering of EU-lidstaten.
2. De Goedkeuring Eindelijk Wanneer de drug toont doeltreffendheid, kwaliteit en veiligheid en is goedgekeurd voor marketing.
"Het probleem is wat zij noemen de Death Valley De periode verstreken sinds de status van weesgeneesmiddel ontvangt totdat deze markt komt ", zegt Beatriz Gómez, projectmanager bij het Centrum voor Biomedische Network onderzoek naar zeldzame ziekten (CIBERER).
En in dit stadium zijn meestal te vinden met de hindernis op het krijgen van financiering, publiek of privaat, de klinische proeven, die enkele jaren kan duren ondernemen.
Met het in de handel brengen is geen garantie dat in verschillende staten patiënten om toegang te krijgen tot het geneesmiddel aangezien het proces van de financiering en de prijzen gebeurt in elk land.
Een gids voor onderzoekers

CIBERER en de Spaanse Agentschap voor Geneesmiddelen en Gezondheidsproducten (AEMPS) lanceerde een korte handleiding om onderzoekers te helpen bij de ontwikkeling van weesgeneesmiddelen ontmaskering van de complexiteit van het proces.
CIBERER, die stimuleert en coördineert de verschillende onderzoeksgroepen met een zeldzame ziekte projecten in Spanje, werkt ook voor de ontwikkeling van nieuwe therapeutische strategieën.
In die zin is dit onderzoekscentrum netwerken bevorderd en zes aangewezen als weesgeneesmiddelen door de EMA, drie van hen ook benoemd door de FDA.
Deze drie geneesmiddelen gentherapie (techniek die het gemuteerde gen vervangt door een ander direct aan zeldzame genetische ziekten) en andere 3 herpositioneren medicijnen al gebruikt voor een andere ziekte die nuttig zijn voor sommige zeldzame ziekten. In het laatste geval zijn de kosten minder dan


